の 誘導適合-理論はコシュランドに戻り、解剖学的構造の適合の精度に基づくキーロック原理の拡張に対応します。誘導適合とは、構造を変えて酵素-リガンド複合体を形成するキナーゼなどの酵素を指します。酵素欠損症の場合、誘発された適合原理は障害によって影響を受ける可能性があります。
誘導フィットとは何ですか?

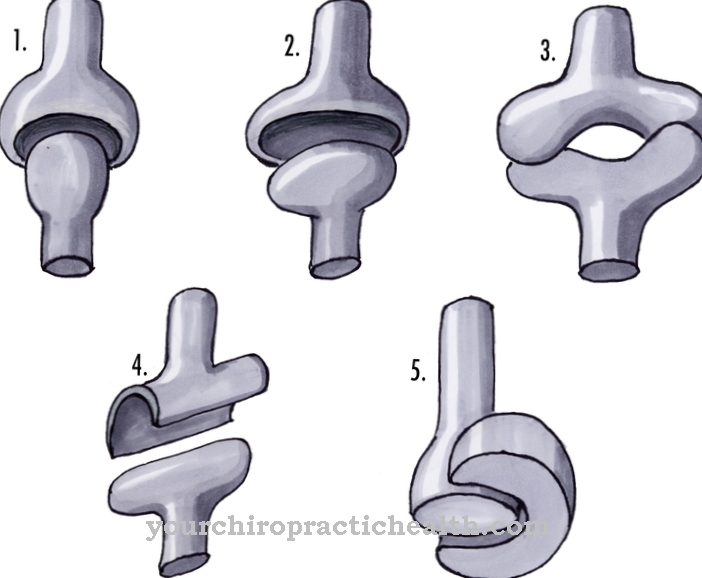
体内の多くのプロセスは、キーロックまたは手袋をはめた原理で機能します。これは、たとえば、多関節接続に適用されます。ジョイントヘッドは、ロックのキーや手袋の手のようにジョイントソケットに係合します。ドアは、鍵が完全にロックされているときにのみ開きます。同じ文脈で、身体の特定の機能は、構造が正確に出会ったときにのみ開かれます。
Induced-fitは、キーインロック原理の特別な形式です。これは、タンパク質-リガンド複合体、たとえば酵素触媒反応の文脈における酵素-基質複合体の形成に関する理論です。
ダニエルE.コシュランドは理論を最初に説明したと考えられており、1958年にそれを最初に仮定しました。キーロックの原理とは異なり、誘導適合理論では2つの静的構造を想定していません。特にタンパク質-リガンド複合体の場合、関与するタンパク質の構造変化により、複合体の形成が可能になるはずです。リガンドとタンパク質、またはむしろ酵素、コシュランドは動的と見なされ、複雑な形成のために両方のパートナーをコンフォメーションの変化に移動させる相互作用について話しました。
機能とタスク
酵素と基質の間には結合特異性があります。このバインディングの特異性は、キーロックの原則を意味します。各酵素には活性中心があります。リガンドとの複雑な形成の場合、この中心は、目的の基質の空間形状にほぼ完全に一致するように正確に形作られています。
しかしながら、多くの酵素の場合、活性中心は、いずれの場合にも、基質に結合されていない限り、あまり正確ではない形態である。酵素とそのリガンドは最初はその形状に適応しているように見えるため、この観察は鍵と鍵の原理に矛盾しているようです。
酵素がリガンドに付着するとすぐに、分子間相互作用が生じます。分子間レベルでのこれらの相互作用により、酵素の構造が変化します。立体配座は、軸を中心とした単純な回転から生じる、分子内の個々の原子のさまざまな可能な配置を意味すると理解されています。酵素のコンフォメーションの変化は、それらの分子の空間配置の変化に対応し、酵素と基質の複合体の形成のみを可能にします。
酵素としてのヘキソキナーゼは、例えば解糖の第一段階を触媒する。これらの酵素が基質グルコースと接触するとすぐに、「誘発された発作」の形成という意味での誘発された発作を観察することができる。酵素ヘキソキナーゼは、ATPを消費してグルコース-6-リン酸を形成することにより、リガンドのグルコースをリン酸化します。
水の構造は、酵素が反応中にリン酸化するC6原子のアルコールグループ内の構造に似ています。サイズが小さいため、水分子が酵素の活性中心に付着し、ATPの加水分解が発生します。しかしながら、誘導適合は、ヘキソキナーゼが高い特異性でグルコース変換を触媒することを可能にするので、ATP加水分解はわずかに起こる必要がある。 誘導適合メカニズムにより、基質特異性が増加します。
人体内の原理は、特にキナーゼの場合に観察できます。両方のパートナーの構造変化は多くの場合自然な限界であるため、誘導された適応はすべてのリガンド-受容体複合体には適用されません。
病気と病気
異なる酵素欠損の場合、誘導適合の原理は妨げられます。たとえば、フェニルケトン尿症では、酵素の活性が制限されているか、完全に機能しなくなります。通常、これは遺伝的欠陥が原因です。フェニルケトン尿症では、酵素フェニルアラニンヒドロキシラーゼに欠陥があります。フェニルアラニンはもはやチロシンに変換されず、それに応じて蓄積されます。神経毒性物質が発生するため、精神障害に加えて、患者は痙攣する傾向があります。 酵素の欠陥は通常遺伝的であり、DNAのアミノ酸配列が正しくコーディングされていないことが原因です。
酵素欠損によって引き起こされる代謝性疾患およびそのような誘発された適合原理の妨害は、酵素障害として知られています。ピルビン酸キナーゼ欠損は、例えば、誤ってコードするPKLR遺伝子に存在する。この遺伝子は、第1染色体の遺伝子座1q22にあります。ピルビン酸キナーゼのPKLR対立遺伝子のさまざまな変異が知られており、R型の欠損として現れます。
Hers病は再びVI型グリコーゲン症と呼ばれ、グリコーゲン蓄積症のグループに属します。これは、酵素欠損による常染色体劣性またはX連鎖代謝障害です。より正確には、原因は、肝臓と筋肉内のホスホリラーゼキナーゼシステムのさまざまな酵素欠損にあります。この文脈において、例えば、肝臓におけるX連鎖ホスホリラーゼ-b-キナーゼ欠損、常染色体劣性遺伝の肝臓ホスホリラーゼ欠損、ならびに肝臓および筋肉内のホスホリラーゼ-b-キナーゼの複合不全が知られている。
肝ホスホリラーゼに関連して、原因となる変異はPYGL遺伝子に局在していたため、染色体14q21からq22に存在します。組み合わされた肝筋ホスホリラーゼ欠損症は、遺伝子座16q12-q13のPHKB遺伝子の変異に関連しています。遺伝子座Xp22.2-p22.1のPHKA2遺伝子の原因となる変異は、肝ホスホリラーゼキナーゼのX連鎖欠損で確認されました。他のグリコゲノースも、対応するキナーゼの誘導適合効果を相殺したり、より困難にすることができます。