生物における複雑な細胞および生理学的プロセスは、例えば生息地への動物または植物の適応性を確保するために、分子レベルでの微調整された調節を必要とします。この目的のために、細胞コミュニケーション、代謝または細胞分裂などのプロセスに介入する多数の分子があります。これらの分子の1つはタンパク質です カルモジュリンこれは、カルシウムの助けを借りて、他の多くの生物学的に活性なタンパク質の機能に影響を与えます。
カルモジュリンとは?
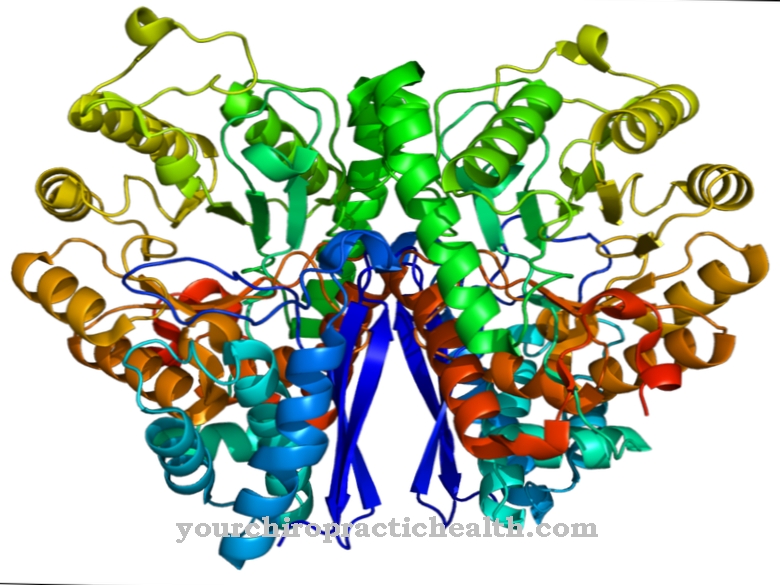
カルモジュリンは、カルシウムイオンと結合する細胞内調節タンパク質です。その構造のため、EF-handタンパク質のグループに属します。 148個のアミノ酸から成り、長さが6.5 nmのカルモジュリンの形は、ダンベルに似ています。このタンパク質分子の分子量は約17 kDaです。
カルモジュリンは、細胞内の信号伝達におけるその生物学的機能のために、セカンドメッセンジャー、すなわち、それ自体は酵素的に活性ではない二次メッセンジャー物質として分類することもできます。タンパク質の2つの球状ドメインには、1.1 nmの距離に2つのヘリックスループヘリックスモチーフがあり、そこに合計4つのカルシウムイオンを結合できます。この構造は、EFハンドと呼ばれます。 EFハンド構造は、カルモジュリンの逆平行ベータシート間の水素結合によって接続されています。
機能、効果、タスク
カルモジュリンが活性化するには、分子あたり3〜4つの結合カルシウムイオンが必要です。活性化された状態では、形成されたカルシウム-カルモジュリン複合体は、多種多様な機能を持つ多数の受容体、酵素、およびイオンチャネルの調節に関与しています。調節された酵素には、免疫応答の調節に重要な役割を果たすホスファターゼカルシニューリン、NOを生成する内皮型一酸化窒素シンターゼ(eNOS)が含まれます。血管。
低カルシウム濃度では、アデニル酸シクラーゼ(AC)も活性化されます。一方、高カルシウム濃度では、酵素の対応物であるホスホジエステラーゼ(PDE)も活性化されます。このようにして、調整メカニズムの年代順のシーケンスが達成されます。最初にACがサイクリックAMP(cAMP)の生成を介して信号パスを動かし、後でこれはcAMPの劣化を介して相手のPDEによって再びオフになります。しかしながら、以下により詳細に説明される、CaMキナーゼIIまたはミオシン軽鎖キナーゼ(MLCK)などのプロテインキナーゼに対するカルモジュリンの調節効果は、特に知られている。
CAMKIIはリン酸残基をさまざまなタンパク質に結合し、それによってエネルギー代謝、イオンの透過性、および細胞からの神経伝達物質の放出に影響を与えることができます。 CAMKIIは脳内で特に高濃度で見られ、ニューロンの可塑性に重要な役割を果たします。すべての学習プロセス。しかし、カルモジュリンは運動プロセスにも不可欠です。安静時には、筋肉細胞内のカルシウムイオンの濃度は非常に低く、したがってカルモジュリンは不活性です。ただし、筋肉細胞が興奮すると、カルシウムが細胞血漿に流れ込み、補因子として、カルモジュリン上の4つの結合部位を占有します。
これにより、ミオシン軽鎖キナーゼが活性化され、細胞内の収縮性繊維が移動し、筋肉の収縮が可能になります。カルモジュリンの影響下にある他のあまり知られていない酵素は、グアニル酸シクラーゼ、Ca-Mg-ATPaseおよびホスホリパーゼA2です。
教育、発生、特性および最適値
カルモジュリンは、すべての植物、動物、菌類、およびアメーバ様生物のグループを含むすべての真核生物に存在します。これらの生物のカルモジュリン分子は通常、比較的類似した方法で構造化されているため、初期の段階で出現した進化的に非常に古いタンパク質であると推測できます。
原則として、カルモジュリンは細胞の血漿中に比較的大量に存在します。たとえば、神経細胞のサイトゾルでは、通常の濃度は約30〜50 µMです。 0.03〜0.05 mol / Lこのタンパク質は、CALM遺伝子を使用して転写および翻訳中に形成されます。CALLM遺伝子には、CALM-1、CALM-2、およびCALM-3と呼ばれる3つの対立遺伝子があります。
病気と障害
カルモジュリンに阻害作用を及ぼす可能性のある化学物質がいくつかあり、そのためカルモジュリン阻害剤として知られています。ほとんどの場合、それらの阻害効果は、細胞からカルシウムを輸送し、カルモジュリンからカルシウムを取り除くという事実に基づいています。カルモジュリンは、不活性状態でのみ存在します。
これらの阻害物質には、例えば、W-7が含まれる。さらに、いくつかの向精神性フェノチアジン薬はカルモジュリンを阻害します。カルモジュリンの調節機能と同様に、タンパク質が補因子カルシウムによって活性化できなくなり、調節された標的酵素も活性が低下すると、考えられる欠陥や障害が多様化します。たとえば、CAMKIIの不十分な活性化は、学習プロセスの基礎を形成する神経可塑性の制限につながる可能性があります。
MLCKの活性化が低下すると、筋肉の収縮が損なわれ、運動障害を引き起こす可能性があります。カルモジュリン欠乏による酵素カルシニューリンの活性化が少ないと、体の免疫反応に影響を及ぼし、eNOの活性化が少ないと、NO濃度が低くなります。後者は主に問題を引き起こし、そうでなければ一酸化窒素は望ましくない血液凝固を防ぎ、血液循環を改善するために血管を拡張するはずです。ただし、この時点で、カルシウムセンサーのフレケニンが特定の条件下でカルモジュリンの生物学的機能を引き継ぎ、分子を置き換えることができることにも言及する必要があります。

.jpg)

.jpg)




.jpg)


.jpg)
